Amyloïdes fonctionnels et adaptation bactérienne
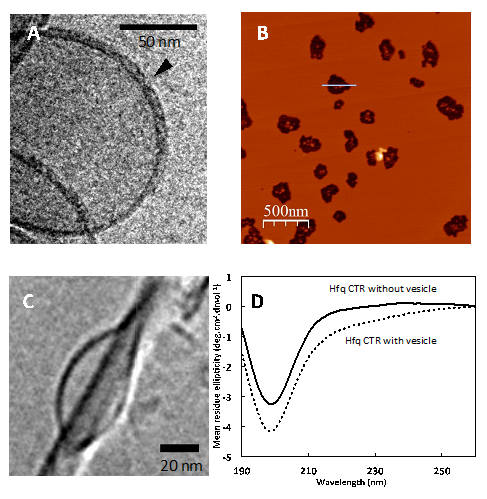
Pour survivre dans leur milieu, les bactéries doivent s'adapter à des conditions de croissance très différentes. Parmi leurs techniques d’adaptation, les bactéries utilisent une protéine appelée Hfq et des acides ribonucléiques (ARN) qui lui sont associés. Une équipe du CEA/IRAMIS/LLB, en collaboration avec des équipes de SOLEIL (ligne DISCO), de l’I2BC/CEA, de l’Institut Curie d’Orsay et de l’ICP de Madrid, a pu montrer que la protéine Hfq forme des structures amyloïdes, comme celles retrouvées lors de maladies neuro-dégénératives, et que ces structures affectent l’intégrité de la membrane bactérienne. Pour cette recherche, différentes approches de biophysique ont été employées, telles que la diffusion aux petits angles (SAXS et SANS), la microscopie moléculaire (TEM et AFM) et la spectroscopie (SRCD sur la ligne DISCO, et fluorescence).
Les bactéries sont des organismes unicellulaires qui doivent constamment s'adapter aux changements du milieu extérieur. Cette propriété est de première importance lorsque les bactéries doivent coloniser un hôte, notamment les bactéries pathogènes qui doivent ajuster leur métabolisme en fonction des conditions de croissance trouvées dans cet hôte. Pour ce faire, elles ont donc dû développer des moyens pour changer rapidement les protéines qu’elles expriment et apprendre à communiquer entre elles. Bien que la façon dont elles s'adaptent à leur milieu ne soit pas encore complètement comprise, il a récemment été montré que l’un des moyens utilisés fait intervenir une protéine appelée Hfq et des acides ribonucléiques de petite taille ne codant pour aucune protéine (appelés ARN non codants). Ces deux partenaires permettent à la bactérie de changer rapidement son expression génétique, par exemple lors d’une carence en fer.
Une étude récente, effectuée par une équipe du CEA/IRAMIS/LLB associée à des équipes de la ligne DISCO à SOLEIL, de l’I2BC, de l’Institut Curie d’Orsay et de l’ICP de Madrid, a permis de prouver que les deux partenaires (Hfq et ARN) ont la propriété de s’assembler en nanostructures. Les chercheurs ont notamment montré que Hfq forme des assemblages de types amyloïdes, comme ceux retrouvés dans des pathologies neuro-dégénératives. Cependant, contrairement aux amyloïdes de la cellule eucaryote, dans ce cas les assemblages formés ont une fonction servant la physiologie de la cellule bactérienne et sont alors appelés amyloïdes fonctionnels.
Différentes approches de biophysique ont été menées en vue de caractériser ces nanostructures, notamment par diffusion aux petits angles des rayons X (SAXS) ou des neutrons (SANS), microscopie électronique à transmission (cryo-TEM) et à force atomique (AFM), et spectroscopie de fluorescence et de dichroïsme circulaire utilisant le rayonnement synchrotron (SRCD).
Très récemment ces équipes ont, de plus, pu mettre à jour une nouvelle propriété des assemblages de Hfq: leur capacité à interagir avec les membranes bactériennes et en affecter l’intégrité. Ces travaux publiés dans la revue Scientific reports ouvrent de nouvelles perspectives sur les moyens de communication utilisés par les bactéries. En effet, on sait déjà que les bactéries utilisent de petites molécules pour communiquer entre elles (système dit du « quorum sensing »). Mais ces nouveaux travaux suggèrent que la protéine Hfq pourrait permettre l’export de courts acides nucléiques entiers hors de la bactérie en formant des pores transitoires dans la membrane de celle-ci. Cette hypothèse est basée sur le fait que des ARN non codants sont retrouvés dans l'espace extracellulaire, ce qui permettrait l'échange direct de matériel génétique entre bactéries. Cependant le mécanisme moléculaire précis doit encore être identifié. Au final, la compréhension de cette nouvelle voie de régulation pourrait être utilisée pour développer de nouveaux antibiotiques.