Une membrane-modèle pour étudier l’effet de l’amoxicilline sur les cellules
L’amoxicilline (AMX) est un antibiotique dont le mécanisme d’action favorise la lyse et ainsi la mort de certains types de bactéries. L’AMX est le traitement classique pour lutter contre différentes infections d’origine bactérienne, par exemple contre Helicobacter pylori (H. pylori), notamment responsable des ulcères. L’AMX est toutefois associée à certains effets secondaires gastro-intestinaux et rénaux et présente une toxicité plus forte quand le pH est bas.
Compte tenu de cette association, ainsi que de l’existence d’un gradient de pH dans la muqueuse gastrique, les chercheurs de l’UCIBIO/REQUIMTE, de I3S et du CESPU (Portugal) ont voulu évaluer l’influence du pH sur la toxicité de l’AMX, toxicité qui pourrait être liée à une interaction directe avec la membrane cellulaire.
Leurs résultats, notamment obtenus sur la ligne de lumière SIRIUS, sont publiés dans la revue BBA, Biomembranes.
L’amoxicilline est un antibiotique semi-synthétique utilisé dans le monde entier. C’est le traitement classiquement mis en œuvre pour lutter contre diverses infections d’origine bactérienne et c’est l’antibiotique le plus fréquemment prescrit dans 22 des 30 pays de l’Union européenne.
Cependant, l’AMX est également associé à certains effets secondaires gastro-intestinaux et rénaux, et sa toxicité est d’autant plus importante que le pH du milieu est bas. La présente étude se concentre sur l’analyse de l’impact de l’AMX sur les couches de phospholipides présentes sur la muqueuse gastrique -dont on connaît le gradient de pH.
Un modèle de biomembrane et une combinaison de techniques
Pour cette étude, des monocouches à l’interface air/liquide ont servi de modèle de membrane simplifiée car elles présentent l’avantage d’éviter toute interférence par des phénomènes de flip-flop dans la membrane (échange de lipide(s) entre la couche externe et le couche interne de la bicouche) tout en préservant les propriétés des membranes biologiques. La composition des phospholipides et le pH ont été choisis de façon à optimiser ce modèle. Dans ce but, des monocouches de 2-dipalmitoyl-sn-glycéro-3-phosphocholine (DPPC) ont été utilisées, car les lipides à tête phosphatidylcholines sont les plus abondants dans les membranes biologiques.
Pour déterminer les effets de l’AMX, différentes techniques complémentaires ont été employées, parmi lesquelles des mesures thermodynamiques, la spectroscopie infrarouge de réflexion-absorption (IRRAS), la diffraction des rayons X en incidence rasante (GIXD) sur la ligne SIRIUS à SOLEIL, et la microscopie à l’angle de Brewster (BAM).
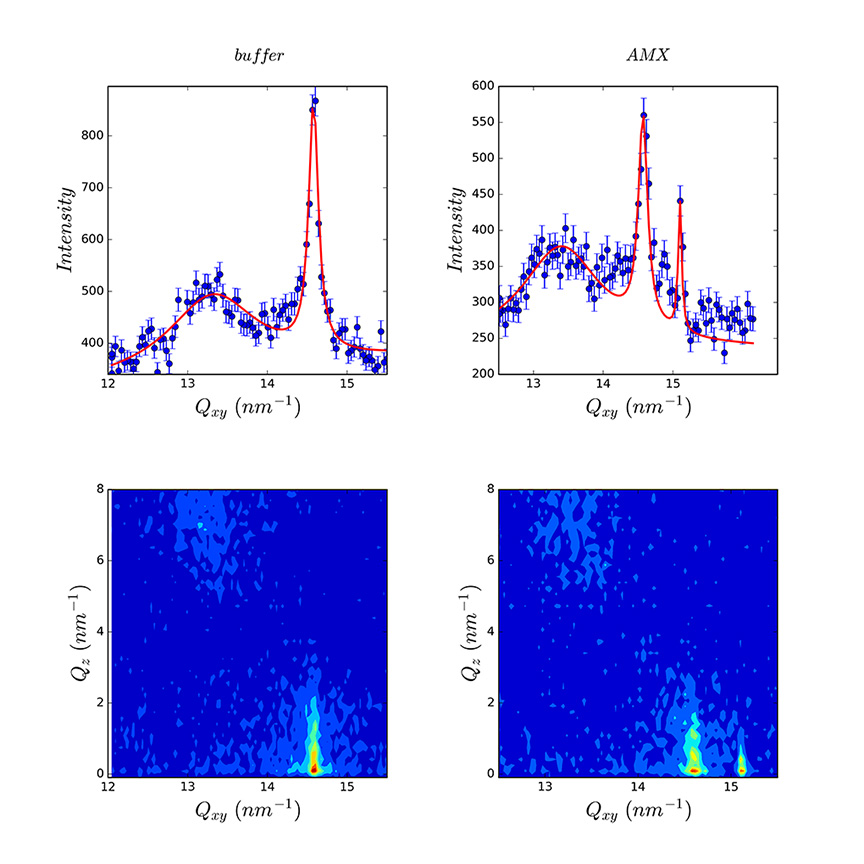
Les monocouches de DPPC étalées sur différentes solutions tampon (pH 1,2, pH 5 et pH 7,4) ont présenté des propriétés structurales et d’organisation différentes, pour l’étude desquelles les expériences de GIXD sont cruciales.
L’interaction entre l’AMX et une monocouche de DPPC dépend de l’état de protonation à la fois de l’AMX et de la DPPC, protonation qui varie en fonction du pH.
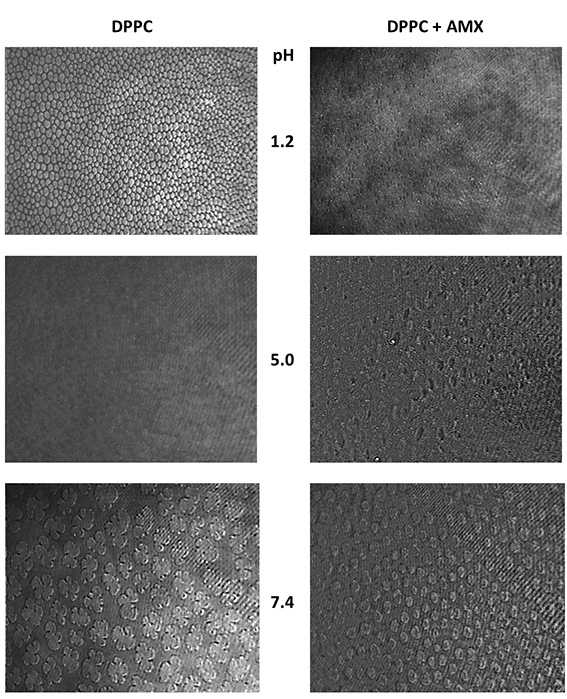
À pH 1,2, la présence d’AMX provoque la formation d’une monocouche très compacte. Les résultats de GIXD ont montré un effet renforcé à basse pression avec altération de l’angle d’inclinaison des chaînes hydrophobes. Sur les images de BAM, la formation de pores est visualisée en présence d’une sous-phase AMX (figure 1).
À pH 5, l’effet global de l’AMX est semblable à celui observé à pH 1,2. Macroscopiquement (mesure isotherme de la pression superficielle durant la compression, isotherme de Langmuir), les changements intervenant dans l’aire par lipide et dans le module d’élasticité sont cohérents avec un empilement plus important des phospholipides en présence d’AMX.
Cet effet se retrouve également dans les résultats de la PM-IRRAS et de la BAM dans lesquels, à 15 mN.m-1, un film lipidique est visualisé en présence d’AMX tandis que des domaines distincts sont visibles dans de la DPPC simple.
La présence de pores est également visualisée même si les états de protonation de la DPPC et de l’AMX diffèrent de ceux vérifiés à pH 1,2. Les modifications survenant dans l’arrangement structural de la DPPC se retrouvent dans le pic de Bragg additionnel en présence d’AMX (figure 2). Cela suggère la démixion du film en domaine de DPPC pure et en domaines où la DPPC est affectée par la présence d’AMX.
À pH 7,4 et à 10 mN/m, l’interaction entre l’AMX et la DPPC se traduit par un empilement réduit. En prenant en compte les résultats de GIXD et de l’effet global de l’AMX, les chercheurs suggèrent que des interactions électrostatiques à 10 mN/m se produisent entre la charge négative de l’AMX et la charge positive de la tête choline de la DPPC. Le reste de la molécule peut donc s’intercaler parmi les chaînes phospholipidiques, ce qui empêche l’inclinaison des phospholipides DPPC et toute modification de son arrangement structural.
D’après l’isotherme de Langmuir, l’AMX augmente également la fluidité du film lipidique. À haute pression néanmoins, l’AMX semble être expulsée du film lipidique et ce phénomène est visualisé sur l’isotherme de Langmuir.
Les résultats de la technique BAM sont également cohérents avec cette interprétation car, à 10 mN/m, l’AMX modifie la forme des domaines sans toutefois générer d’effet visuel à haute pression.
Les variations du pH affectent l’état de protonation de l’AMX et de la DPPC et par là même leur interaction.
L’AMX peut induire la formation de pores dans le film lipidique de la DPPC à pH 1,2 et pH 5 probablement en raison de la dimérisation de l’AMX dans des conditions acides. Il est possible que la perturbation des barrières biologiques en conditions acides et, au final, la formation de pores, puissent avoir un lien avec la gastrotoxicité in vivo de l’AMX.
À pH 7,4 et à basse pression, l’AMX diminue l’organisation de la monocouche. Cependant, à des pressions plus élevées, notamment à 30 mN/m (qui est la pression latérale des membranes biologiques), l’AMX est expulsée du film lipidique, avec restauration partielle des propriétés biophysiques de la monocouche.
À pH acide, des perturbations plus importantes sont visibles, au cours desquelles des pores ont été visualisés par microscopie à l’angle de Brewster. En définitive, ces perturbations peuvent être liées à la toxicité de l’amoxicilline.
En conclusion, cette étude utilisant une combinaison de techniques, dont la GIXD effectuée sur la ligne SIRIUS, montre que les variations du pH affectent l’état de protonation de l’AMX et de la DPPC et, par conséquent, affectent leur interaction. Au final, cela peut affecter les effets toxiques de l’AMX observés in vivo.