Une auto-métallation maitrisée des porphyrines à l’interface solide/gaz pour des applications en électronique moléculaire
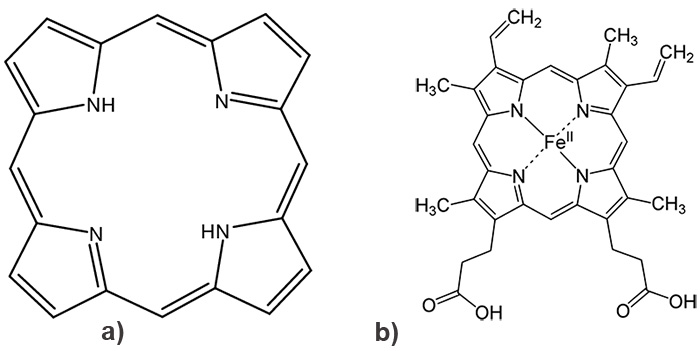
Les métalloporphyrines sont de grosses molécules (fig. 1) dont la structure cyclique inclut un atome de métal. Leur rôle, primordial dans les processus biologiques, dépend principalement de la nature du métal qu’elles contiennent : par exemple la chlorophylle (photosynthèse) contient une porphyrine avec du magnésium ; l'hémoglobine (transport d'oxygène) inclut une porphyrine de fer. Leurs propriétés électroniques variées présentent un fort intérêt pour l'électronique moléculaire, les capteurs chimiques ou le photovoltaïque. C’est pourquoi les scientifiques cherchent à maîtriser leur synthèse.
Grâce à un équipement spécifique installé sur la ligne TEMPO par Sorbonne Université, des chercheurs de l’Université de Trieste ont montré que l’apport de d’oxygène gazeux facilite l’étape de métallation des porphyrines, qui peut ainsi avoir lieu à température ambiante.
L’une des étapes cruciales de la synthèse d’une métalloporphyrine est l'inclusion de l’atome de métal au cœur du cycle (dit tétrapyrrolique) de la molécule.
Dans la nature, cette réaction est catalysée par des enzymes, appelées chélatases, et a lieu à température ambiante. En laboratoire, l’adsorption de la porphyrine sur une surface métallique permet de placer la molécule dans les conditions nécessaires à la métallation : des atomes métalliques de la surface peuvent alors diffuser dans la molécule, et s’y associer par auto-assemblage ; on parle d’auto-métallation. Or, il s’agit d’une réaction pouvant nécessiter une énergie d’activation importante, qui représente un obstacle. Dans la nature le rôle du catalyseur (c’est-à-dire l’enzyme) est de réduire cette barrière d’énergie pour que la réaction devienne possible. Mais en laboratoire il faut trouver d’autres moyens pour baisser cette barrière énergétique. L’un d’eux consiste à atteindre un état intermédiaire de réaction –dans lequel la molécule de porphyrine devient plus susceptible de lier un atome de métal– en oxydant préalablement la surface sur laquelle la porphyrine est adsorbée. Il « suffit » ensuite d’augmenter la température pour que la barrière d'activation soit franchie, et la métallation de la porphyrine peut avoir lieu. Mais les températures élevées nécessaires peuvent endommager la molécule.
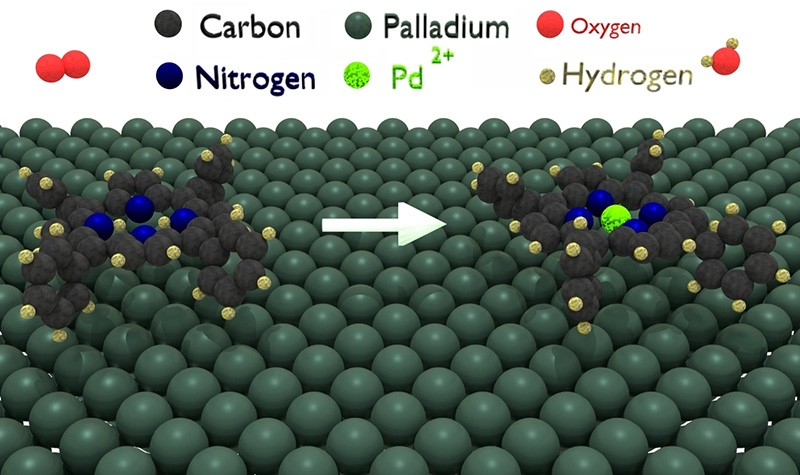
Dans le cadre d'une collaboration entre le Département de Physique de l'Université de Trieste, l'institut CNR-IOM, et l’équipe associée de la ligne TEMPO, il a été démontré que l'auto-métallation de molécules de tétraphénylporphyrine hydrogénées (ou « 2H-TPP », composé synthétique ressemblant à la porphyrine naturelle) adsorbées sur une surface de Palladium (Pd(100) ; figure 2) peut être favorisée grâce à l'oxygène gazeux, et cela dans des conditions de température et pression proches des conditions ambiantes. Le système gaz-molécule-surface se rapproche de l’environnement existant dans la poche catalytique de l’enzyme où et lorsque la réaction a lieu dans la nature.
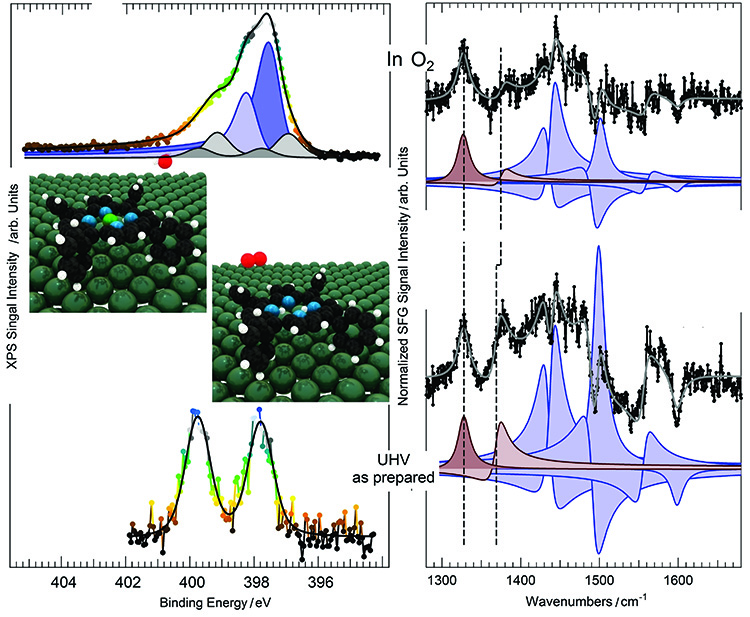
Ce résultat a pu être mis en évidence grâce à la combinaison unique d'expériences de spectroscopie vibrationnelle (appelée génération des fréquences somme visible-infrarouge, ou IR-Vis SFG) menées à l’Université de Trieste, et de spectroscopie de photoélectrons X à pression quasi ambiante (NAP-XPS), sur la ligne TEMPO.
Il est ainsi apparu que l'auto-métallation peut être induite par l'oxygène en phase gazeuse dès la température ambiante. La barrière énergétique mesurée est seulement de 0,37-0,4 eV. Les atomes d'hydrogène pyrroliques réagissent grâce à la médiation d'un atome de Pd de la surface jouant le rôle de catalyseur, pour former de l'hydrogène moléculaire (figure 3). Les mêmes atomes d'hydrogène pyrrolique au centre de la molécule peuvent être transférés à un atome d'oxygène, toujours avec la médiation catalytique d’un atome de Pd, ce qui produit alors de l'eau. Une autre voie fait intervenir la surface de Pd(100), qui accueille les atomes d'hydrogène après la métallation et avant la désorption de la métalloporphyrine.
Cependant, les résultats de calculs et les données expérimentales montrent que les barrières d'activation dépendent du type de surface et du métal lié à la porphyrine : les barrières en énergie ont des valeurs couvrant une gamme allant de zéro ou quasiment, jusqu’à 1,5 eV. Dans cette étude, la valeur obtenue (0,4 eV) se situe dans la partie la plus basse de cette gamme, confirmant que cette nouvelle voie de métallation est techniquement accessible.
Ce résultat permet d’envisager de nouveaux procédés de métallation de structures organiques sur des surfaces et, dans le cas des métalloporphyrines, pourrait mener à la synthèse de molécules utilisées par exemple pour la photocatalyse (conversion de l'énergie solaire), la production d'hydrogène à partir d’eau (« water splitting » ou craquage de l’eau), la conception de biocapteurs....