Suivre l’accumulation des molécules d’antibiotiques dans la bactérie résistante
Depuis plusieurs années l’UMR-MD1, Aix-Marseille Université, s’est associée à la ligne DISCO afin de mettre au point une méthode, non-invasive et non perturbante, permettant de déterminer la concentration et la localisation d’antibiotiques, usuels ou de nouvelles molécules, dans la bactérie (lire également http://www.synchrotron-soleil.fr/Soleil/ToutesActualites/2010/BacteriesResistantes). De nouveaux résultats viennent d’être publiés.
L’approche ambitieuse de l’équipe de Jean-Marie Pagès avait comme objectif de s’adresser dans le même temps à la population bactérienne dans son ensemble et à la bactérie isolée au sein de cette population.
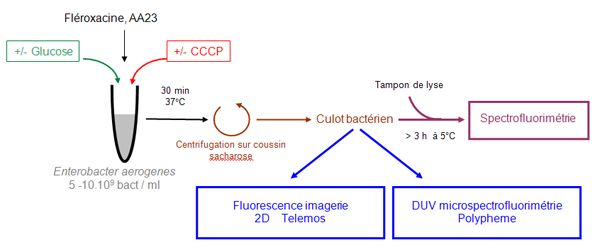
La méthode développée sur la ligne DISCO s’appuie sur une analyse simultanée, fluorimétrie, microfluorimétrie, et imagerie 2D, d’un échantillon selon le schéma présenté figure 1.
Cette démarche expérimentale permet ainsi d’obtenir la concentration de la molécule étudiée à l’échelle de la population (macro-analyse), à l’échelle de la bactérie isolée (micro-analyse) et d’avoir la localisation 2D sur une bactérie isolée (réf 1-2).
Cette approche s’accompagne de la détermination de l’activité antibactérienne mesurée sur les mêmes souches afin de pouvoir corréler activité, localisation et concentration des antibiotiques étudiés. La mesure est réalisée sur des souches exprimant ou non le système d‘efflux responsable de l’expulsion des antibiotiques (réf 3).
« Ancien » et nouvel antibiotique
Les antibiotiques testés sont la fleroxacine, antibiotique utilisé depuis plusieurs années et pour lequel il existe des mécanismes de résistance développés par les bactéries, et AA23, une molécule originale récemment produite.
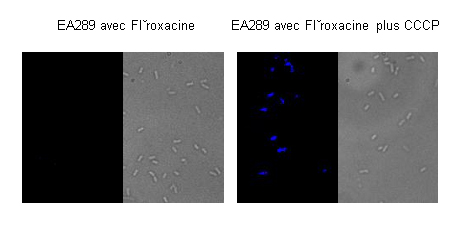
On observe, figure 2A, qu’en présence de fleroxacine seule il n’est pas possible de voir l’accumulation de l’antibiotique dans les bactéries car la fleroxacine (fluorescente) ne reste pas à l’intérieur des bactéries : elles l’expulsent grâce à un système d’efflux, impliqué dans la résistance. Si un découplant d’énergie (CCCP) est ajouté, il va perturber l’activité d’efflux ; l’antibiotique reste dans les bactéries, et on retrouve alors une fluorescence bactérienne traduisant l’accumulation de fleroxacine dans ces bactéries.
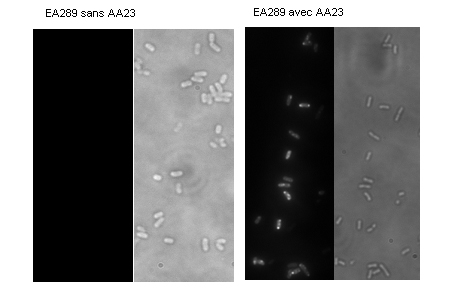
La molécule AA23 a été conçue afin de contourner ce système d’efflux. Ceci est mis en évidence fig.2B : avec la molécule seule, sans ajout de CCCP, on obtient déjà un marquage indiquant qu’AA23 s’accumule dans les bactéries. On observe que ce marquage se fait à certains endroits particuliers dans la bactérie.
De manière intéressante, si l’addition du découplant d’énergie permet de restaurer l’accumulation de fleroxacine dans les bactéries résistantes, on observe une hétérogénéité dans le marquage qui traduit une différence de comportement à l’échelle de la bactérie isolée appartenant à la population ainsi traitée. Ce résultat illustre les bases de l’individualisme bactérien et/ou de la flexibilité de l’adaptation face aux signaux environnementaux comme les agents anti-bactériens.
Références :
1 - Kaščáková S et al. “Antibiotic Transport in Resistant Bacteria: Synchrotron UV Fluorescence Microscopy to Determine Antibiotic Accumulation with Single Cell Resolution.” PLoS One, 2012, 7(6): art;n° 38624
2 - Pagès J.M. et al. « New peptide-based antimicrobials for tackling drug resistance in bacteria: single cell fluorescence imaging.” Med. Chem. Letters, 2013, 4:556.
3 - Nikaido H. & Pagès J.M. “Broad-specificity efflux pumps and their role in multidrug resistance of Gram-negative bacteria.” FEMS Microbiol Rev. 2012, 36:340.