Régulation de l’expression des gènes - Une structure qui décoiffe !
Grâce à l’utilisation des lignes PROXIMA-1 et PROXIMA-2A, des chercheurs de l’Ecole Polytechnique (CNRS, Palaiseau) et de l’IGBMC (CNRS, INSERM et Université de Strasbourg) ont déterminé la structure d’un complexe de protéines : l’enzyme Dcp2, associée à ses deux « molécules d’assistance », les cofacteurs Dcp1 et Edc3. La structure de ce complexe a par ailleurs permis de révéler le mécanisme d’action de Dcp2, impliquée dans l’élimination de la coiffe des ARN messagers (ARNm), une réaction essentielle à la dégradation des ARNm au cours de la synthèse des protéines. Jusqu’à présent, le fonctionnement moléculaire de Dcp2 n’avait pas été élucidé.
Ces résultats sont publiés dans la revue Nature Structural and Molecular Biology.
Dans une cellule, la fabrication des protéines a lieu en plusieurs étapes. La première est la synthèse de « messagers », c’est-à-dire des molécules d’ARNm synthétisées par copie d’un gène donné. Ce sont ces ARNm qui sont ensuite « traduits » en protéines ; la traduction est basée sur les règles du code génétique, qui fait correspondre à chaque triplet de nucléotides de l’ARNm un acide aminé donné de la protéine.
Chez les organismes eucaryotes, les ARNm sont protégés d’une élimination non contrôlée par des éléments stabilisateurs à chacune de leurs extrémités : une coiffe d’un côté (extrémité 5’) et un polymère de molécules d’adénosine (ou « queue poly(A) »), de l’autre (extrémité 3’). L’objectif des équipes de Marc Graille (Ecole Polytechnique) et de Bertrand Séraphin (IGBMC) est de comprendre les mécanismes de dégradation des ARNm et leur contribution à la régulation de l’expression des gènes.
La première étape des voies de dégradation des ARNm est généralement le raccourcissement de leur queue poly(A), ou désadénylation. Cette étape est généralement suivie du clivage de la coiffe qui engage irrémédiablement l’ARNm vers une destruction complète. Le clivage de la coiffe empêche aussi toute production ultérieure de protéines à partir de cet ARNm. En effet l’ARNm doit avoir une extrémité 5’ complète pour que les facteurs de traduction, protéines qui assistent le ribosome lors du démarrage de la traduction de l'ARNm, se fixent correctement à cet ARNm. Le clivage de la coiffe est catalysé par l’enzyme Dcp2. Si ce facteur est connu depuis plus de 10 ans, son mécanisme d’action reste mystérieux car cette enzyme est faiblement active in vitro et requiert de nombreux co-facteurs pour sa fonction in vivo. Plusieurs structures de Dcp2 avaient été décrites mais celles-ci n’expliquaient pas son activité catalytique.
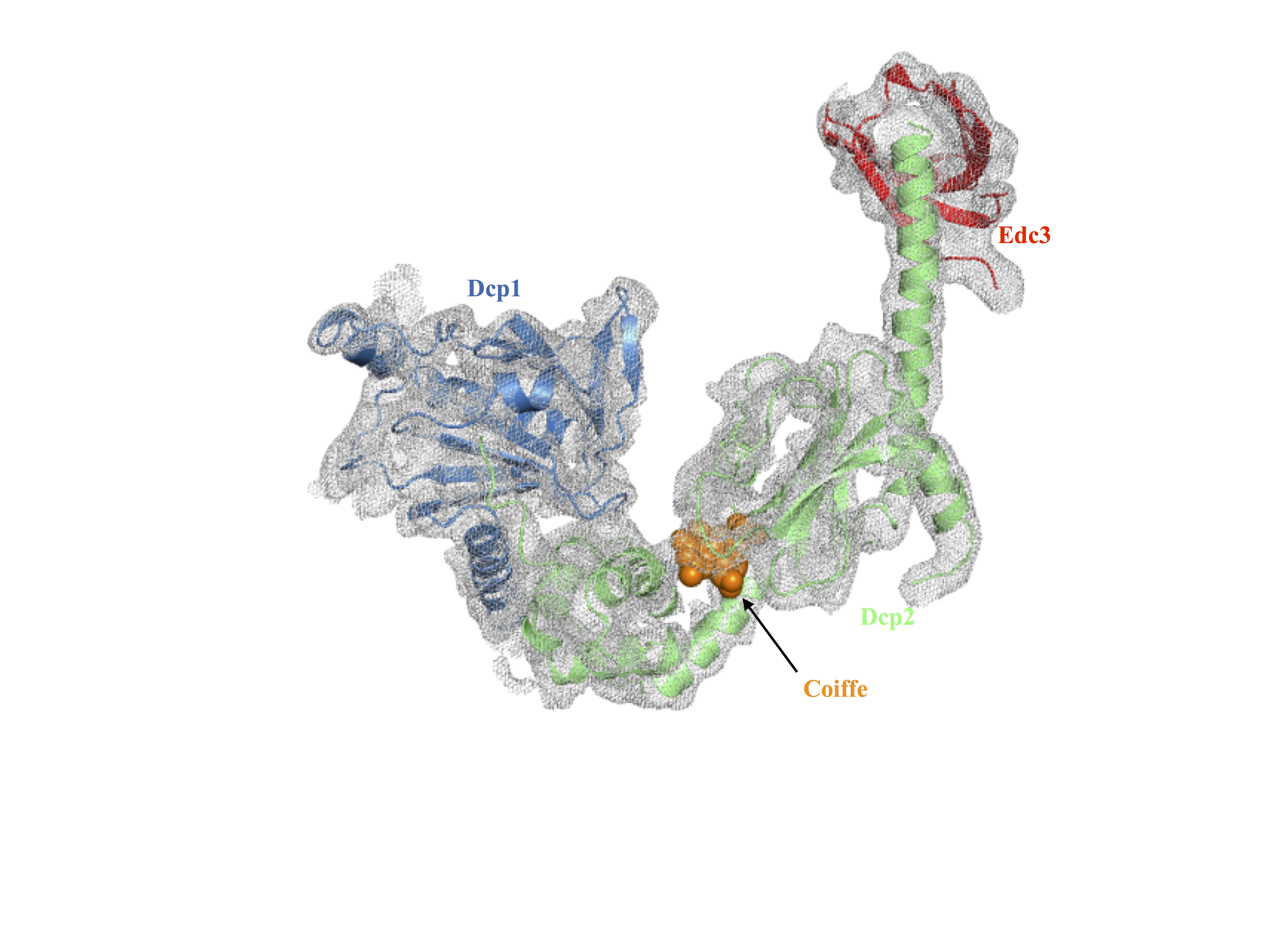
La structure de Dcp2 associée à ses co-activateurs Dcp1 et Edc3 et liée au produit de la réaction de clivage de la coiffe
L’équipe dirigée par Marc Graille a réussi à cristalliser le complexe Dcp2-Dcp1-Edc3 en présence d’un analogue de la coiffe. Des données collectées sur la ligne PROXIMA-2A grâce au détecteur Eiger 9M ont permis de calculer une carte de densité électronique expérimentale à 4Å de résolution. Cela a permis de positionner avec certitude les différents constituants de ce complexe et donc de révéler son organisation. Dans cette structure, deux domaines de Dcp2 prennent en tenaille un nucléotide qui correspond au produit de clivage de la coiffe de l’ARNm par Dcp2, expliquant les données de biochimie publiées précédemment. La structure montre aussi qu’il existe un mécanisme de régulation allostérique de Dcp2 par son activateur Edc3 : Edc3 induit un changement de conformation de Dcp2, ce qui favorise son activité et le recrutement de l’ARN messager.
Ces résultats ouvrent de nouvelles perspectives pour comprendre le mécanisme du clivage de la coiffe et pourraient permettre de développer des inhibiteurs de cette enzyme-clé de la dégradation des ARN messagers, essentielle à la survie des cellules eucaryotes.