Qu’est-ce qui gouverne la chiralité dans le cas de systèmes non-rigides ?
De nombreuses biomolécules importantes (allant des plus petites briques de base telles que les acides aminés aux grandes protéines et à la célèbre double hélice de l'ADN) sont chirales, ce qui signifie qu'elles existent sous forme deux formes gauche/droite à l'instar de nos mains. La plupart des techniques instrumentales ne peuvent distinguer les formes structurelles gauche et droite d'une molécule chirale (l'une étant l'image de l'autre dans une symétrie-miroir), mais les organismes vivants en sont capables en raison de la nature intrinsèquement chirale de la biochimie du vivant.
On peut citer à titre d'exemple notre capacité à distinguer à l'odeur les deux formes de certaines paires chirales. De même, les insectes distinguent les formes chirales des phéromones. Et l'action pharmaceutique de nombreux médicaments dépend de manière critique de leur forme chirale. La compréhension de cette sensibilité biologique à la chiralité repose sur le principe « clé-serrure », d'après lequel une enzyme ou un réactif interagissant avec un substrat doit avoir une forme spatiale adaptée à un site d'interaction spécifique. Dans le cas d'un substrat chiral, ceci nécessite la forme chirale complémentaire, à l'instar d'une main droite qui peut seulement entrer dans un gant droit.
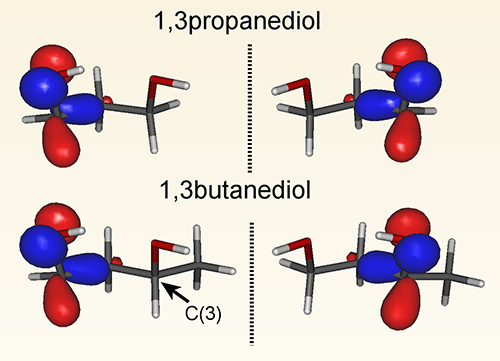
Une collaboration de longue date entre des chercheurs de l'Université de Nottingham (Royaume-Uni) et le groupe DÉSIRS de SOLEIL a conduit à la création et au développement d’une technique, le Dichroïsme Circulaire de Photoélectrons (PECD), qui exploite la capacité à créer un rayonnement synchrotron polarisé circulairement (gauche ou droite) pour sonder de façon sensible la chiralité moléculaire. La technique PECD observe spécifiquement le mouvement asymétrique des électrons issus d’une molécule chirale suite à sa photoionisation. Dans l’étude récente publiée dans Angewandte Chemie, l'équipe a examiné plusieurs petits diols (molécule à deux groupes hydroxyle). Le plus petit diol considéré, le 1,3-propanediol, est constitué d'une chaîne carbonée à trois atomes avec un groupe hydroxyle (OH) fixé à chaque extrémité. En un sens, il s'agit d'une disposition assez symétrique (donc a priori non chirale), mais les groupes OH ont tendance à s'aligner en disposition tête-queue, ce qui crée la possibilité d'une paire chirale par symétrie plane (voir la figure). L'orbitale la plus externe (HOMO) traduit cette symétrie chirale ! Toutefois, les groupes OH pouvant tourner facilement, il est possible de passer rapidement d'une forme à l'autre par interconversion. La chiralité du propanediol est donc seulement transitoire et ses deux formes ne peuvent être isolées. Des interactions avec un substrat chiral peuvent bien sûr stabiliser ou bloquer la rotation du groupe OH, et dans de telles circonstances le propanediol peut adopter la chiralité privilégiée par l'interaction.
L'ajout d'un groupe méthyle à une extrémité conduit au 1,3-butanediol, ce qui ralentit la rotation rapide du groupe OH. La symétrie plane stricte est aussi brisée, mais visiblement sans affecter les dispositions tête-queue (ou conformations) des groupes OH ainsi que la forme de l'orbitale électronique HOMO. La possibilité d'avoir deux formes chirales est localement préservée (voir la figure). Mais le groupe méthyle supplémentaire du butanediol a une autre conséquence : il crée une substitution asymétrique sur ce qui était précédemment l'atome C(3) final, celui-ci devenant ainsi un centre chiral permanent. En termes de disposition des liaisons (configuration) le long de la chaine carbonée, les structures du 1,3-butanediol présentées ici dans la figure sont toutes deux la même forme (dextrogyre) de cette nouvelle paire chirale permanente, qui peut désormais être isolée pour des échantillons commerciaux.
La molécule 1,3-butanediol présente donc deux types de chiralité : une chiralité permanente de configuration (qui peut seulement être permuter en cassant et en reformant des liaisons), et une chiralité de conformation (qui peut être échangée par rotation des liaisons). Laquelle des deux est responsable de la détermination de la chiralité à l’œuvre dans une réaction moléculaire de type reconnaissance chirale ? Dans le cadre d'une étude associant expérience et simulations numériques, l'équipe a utilisé la technique PECD et pu déterminer que la conformation des groupes OH contribue de façon dominante à l'asymétrie chirale observée lorsque l'électron HOMO est excité et ionisé, c'est-à-dire que la chiralité de conformation n'est pas éclipsée par la chiralité de configuration plus durable du squelette carboné. Seule cette réponse de l'électron externe est typiquement ressentie par un partenaire de réaction. Ce résultat est important car il suggère que des changements de chiralité de conformation (facilement induits par des interactions relativement faibles dans le processus d'arrimage réactif-substrat) peuvent parfois s'avérer plus significatifs que la chiralité moléculaire de configuration dont la nature est plus durable, et éclipser celle-ci.