La larve de Galleria mellonella peut-elle vraiment dégrader et métaboliser le polyéthylène ?
Une grande part des centaines de millions de tonnes de plastique produit chaque année s’accumule dans la nature. Exposé aux conditions physicochimiques environnementales, il se fragmente en milliards de débris de microplastiques (< 5mm) et nanoplastiques (< 1 µm), impossibles à collecter et éliminer. C’est pourquoi les scientifiques tentent d’identifier des organismes capables de les biodégrader.
L’équipe GME de l’Institut MICALIS (INRAE/AgroParisTech), l’UMR 800 (CNRS/Institut de Chimie Physique, université Paris-Saclay) et la ligne SMIS à SOLEIL ont cherché à vérifier si la larve de Galleria mellonella peut recycler le polyéthylène (PE) en biomasse, en développant une technique innovante : l’imagerie hyperspectrale infrarouge sur des tissus de larves nourries par du PE marqué au deutérium.
Après les microorganismes, de nouvelles cibles dans la recherche de candidats susceptibles de biodégrader les plastiques sont les larves d’insectes, qui ont prouvé leur capacité à mâcher, ingérer et excréter plusieurs plastiques. Des chercheurs ont récemment montré que la larve de Galleria mellonella (Gm), ou teigne des ruches, peut mâcher et peut-être biodégrader le polyéthylène (PE), c’est-à-dire le fragmenter jusqu’à le réduire en molécules de base, capables de retourner dans le cycle biologique.
Plastique le plus produit au monde, sous formes de PE haute- et ultrahaute-densité (PEHD, PEUHD), ou de PE basse-densité (PEBD), le PE sert à fabriquer des objets à usage unique (sacs plastiques, bouteilles…) mais aussi des implants médicaux. Une fois accumulé dans la nature il mettrait des siècles à se dégrader, certaines formes étant même considérées comme non-biodégradables. Un insecte capable de le biodégrader représenterait donc une précieuse solution pour dépolluer, particulièrement pour éliminer les micro- et nanoplastiques.
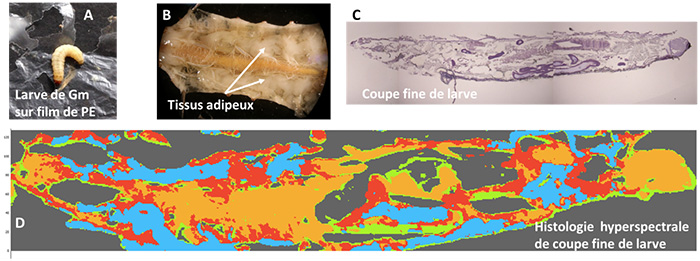
Cependant, bien que la larve de Gm mâche le PE (figure 1A), il n’a pas été formellement démontré qu’elle le transforme en biomasse. La littérature scientifique est d’ailleurs ambigüe sur le rôle de la larve et/ou de son microbiote intestinal.
(A) Larve de Galleria mellonella
(B) Larve disséquée montrant l’importance de ses tissus adipeux.
(C) Coupe d’une larve de 10 µm d’épaisseur observée en microscope optique après coloration, et
(D) par spectroscopie IR.
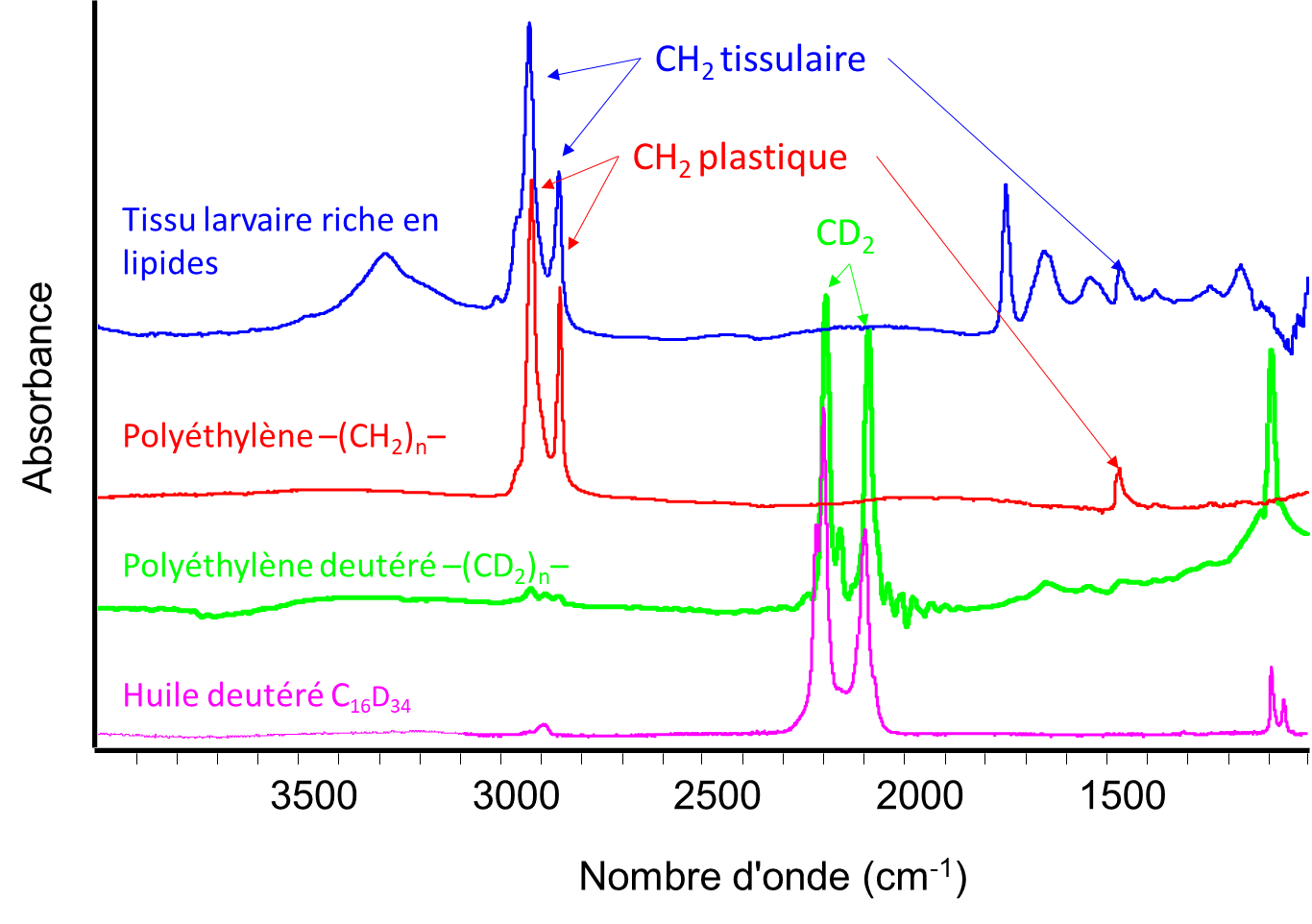
Afin de lever cette ambiguïté, l’équipe de chercheurs a développé une technique combinant imagerie hyperspectrale infrarouge de tissus de larve et marquage isotopique du PE. En effet, la spectroscopie infrarouge ne permet pas de distinguer le PE, de formule chimique [–CH2–]n, des lipides des tissus adipeux de la larve de Gm eux aussi composés majoritairement de CH2 (figure 2). Des larves de Gm ont alors été nourries avec du PEHD marqué par un traceur : le deutérium, isotope de l’hydrogène. Dans ce PEHD marqué, les -CH2– sont remplacés par des groupements deutérés CD2. Or, en spectroscopie infrarouge, ces groupements CD2 se distinguent fortement des groupements CH2 des tissus adipeux de la larve (figure 2). Les PE normaux (CH2) ou deutérés (CD2) ont néanmoins les mêmes propriétés physicochimiques.
Les larves ont été sectionnées en coupes de 10 microns d’épaisseur pour être analysées en imagerie hyperspectrale infrarouge qui permet de reconstruire des cartes chimiques (figure 1D).
Une première étude a montré que, par spectroscopie infrarouge, le deutérium présent aux concentrations naturelles dans les larves est indétectable. Après ingestion de 1 à 4 mg d’huile deutéré (C16D34), le deutérium devient détectable dans certains tissus adipeux des larves au bout de 24h, puis dans la totalité de leurs tissus au bout de 72 h. La spectroscopie infrarouge permet donc de détecter la bioassimilation de quelques milligrammes de nourriture deutérée par les larves puis l’intégration des groupements chimiques –CD2– dans leurs tissus adipeux. De plus, la méthode démontre que les chaines CD2 détectées dans les tissus ont une longueur différente de celles dans l’huile deutérée : elles ont donc bien été fragmentées et les molécules résultantes utilisées pour synthétiser de nouvelles molécules biologiques. La métabolisation de l’huile est prouvée.
Mais si les larves sont nourries avec 2 à 5 mg de PE deutéré, aucune liaison C–D n’est détectée dans leurs tissus. Des particules microscopiques de PE deutéré sont bien détectées tout le long de leur tractus digestif (figure 3) mais il ne semble pas y avoir de bioassimilation. Par contre, l’oxydation du PE et du PE deutéré -première étape d’une biodégradation- a bien été observée dans des tubes digestifs extraits de larves (ex vivo), probablement catalysée par le microbiote intestinal.
L’étude a aussi montré que le PE seul ne favorisait pas la croissance des larves et ne semblait pas avoir de valeur nutritionnelle.
En conclusions, cette étude n’a pas permis de montrer la bioassimilation de PE par Gm, mais sa fragmentation en microparticules. En revanche, l’étude confirme l’hypothèse de l’implication du microbiote dans la biodégradation des plastiques comme déjà montré pour d’autres larves d’insectes.
Les perspectives de cette étude sont l’analyse, par la même méthode, du rôle du microbiote larvaire et de la densité du PE.