Huiles végétales et dérivés. Etude structurale d’une oléosine, protéine au centre d'enjeux énergétiques et médicaux
Dans le contexte actuel d’épuisement des ressources fossiles et de protection de l’environnement, la valorisation énergétique des huiles issues de la biomasse et la chimie verte prennent de l’importance. Ainsi, ces huiles et leurs dérivés biodégradables remplaceront un jour les produits d'origine fossile.
L'équipe DYSCOL (Dynamique et Structure des Corps Lipidiques) de l'Institut Jean-Pierre Bourgin (INRA-AgroParisTech, Versailles) travaille à identifier des facteurs influant sur la qualité et la quantité des huiles produites chez les plantes ou les microorganismes, mais aussi à favoriser le développement de procédés d'extractions des huiles plus efficaces et respectueux de l'environnement. La technique de dichroïsme circulaire disponible sur DISCO leur a permis d’obtenir, dans des conditions proches des conditions physiologiques, des données sur la structure secondaire d’une oléosine, protéine impliquée dans le stockage des huiles chez les plantes oléagineuses.
Dans le cadre de la valorisation des huiles issues de la biomasse pour l'énergie et la chimie verte, deux sources sont envisagées : les huiles végétales, déjà bien implantées, et les huiles produites à partir de microorganismes, actuellement en plein essor. Ces huiles et leurs dérivés biodégradables sont de plus en plus retrouvés dans les produits de grande consommation (biodiésel, savon, produits d’entretien) ou industriels (solvants, lubrifiants).
Huiles, corps lipidiques et chimie verte
Dans les cellules, les huiles sont stockées dans des granules, les corps lipidiques. Ces structures sont présentes chez les eucaryotes supérieurs (mammifères, plantes) et chez certains unicellulaires (bactéries, levures). Les corps lipidiques sont constitués d’un cœur d'huile, entouré par une monocouche de phospholipides dans laquelle sont insérées de nombreuses protéines. En particulier, il existe des protéines structurales hydrophobes qui stabilisent l'interface entre ces inclusions lipidiques et le milieu aqueux (périlipines, apolipoprotéines, oléosines). Les oléosines, de masse comprise entre 15 et 25 kDa, sont les protéines majoritaires du corps lipidique de plantes et recouvrent entièrement sa surface.
La structuration des oléosines : un enjeu économique mais aussi médical
Outre leur importance pour stabiliser les réserves lipidiques de la plante, les oléosines d'arachides sont par ailleurs des protéines allergisantes. De manière plus large, les corps lipidiques, présents aussi chez les mammifères, jouent un rôle important dans des maladies de plus en plus répandues (athérosclérose, obésité, diabète). Ainsi, la compréhension de la structuration des oléosines, et plus largement de l'ensemble des protéines intégrales des corps lipidiques, est un enjeu majeur dans un contexte agronomique, économique mais aussi médical.
Une première : dichroïsme circulaire sur des nanoparticules lipidiques en solution aqueuse
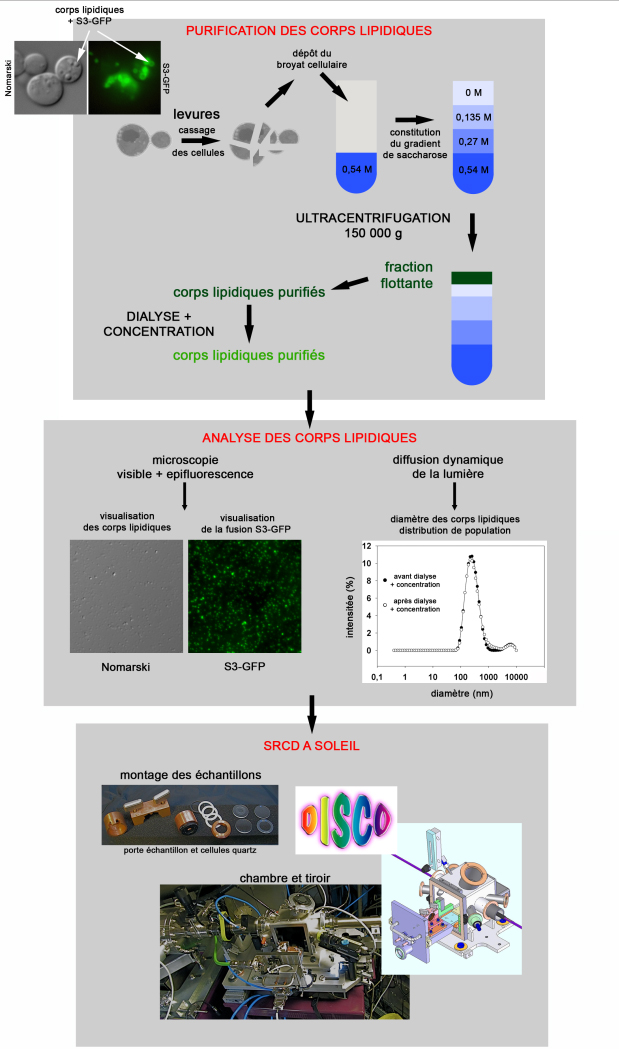
L'équipe DYSCOL utilise comme système cellulaire modèle la « levure de boulanger » (S. cerevisiae) pour l'étude structurale des corps lipidiques et de ses protéines intégrales : les scientifiques font produire par cette levure, facilement « cultivable » en grande quantité en laboratoire, des protéines végétales (expression hétérologue de protéines) puis réalisent un fractionnement cellulaire de façon à séparer les différents composants de ces levures (cf fig.1). Ils ont ainsi pu obtenir des corps lipidiques compatibles avec des analyses structurales.
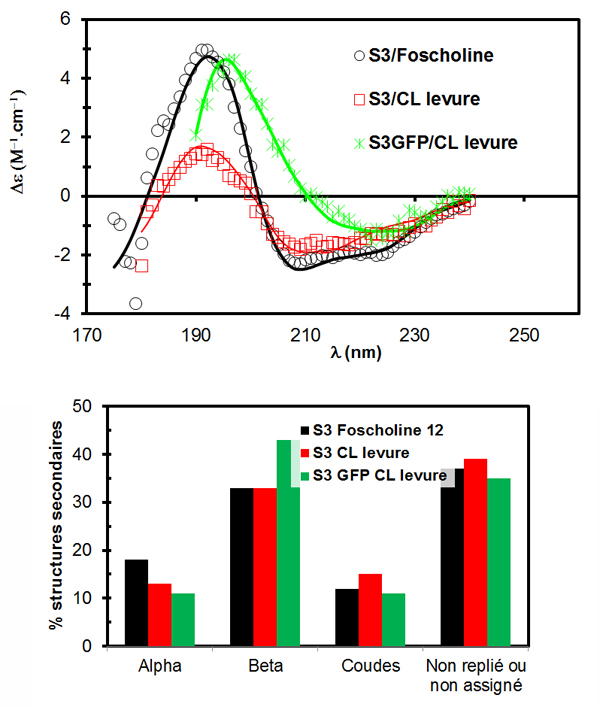
Grâce à cette approche originale, des enregistrements de spectres SRCD (dichroïsme circulaire utilisant le rayonnement synchrotron) sur des corps lipidiques en solution ont pu être obtenus (cf fig.2). Ceci constitue une première : il s’agit des premiers spectres de SRCD obtenus pour des protéines intégrées au sein des nanoparticules (250 nm) que sont les corps lipidiques, maintenues en solution aqueuse. Cet environnement est plus proche des conditions physiologiques, c’est-à-dire de l’environnement naturel des protéines dans la cellule, que les tensioactifs dans lesquels ces protéines sont classiquement mises en solution lors d’études structurales.
L'acquisition de tels spectres en milieu turbide est rendue possible grâce à la brillance du faisceau synchrotron et l'utilisation de solutions compatibles avec les UV. Les acquisitions ont été effectuées dans des cellules en Quartz Suprasil (Hellma) de 100, 200 et 500 µm de trajet optique. Le traitement des spectres et la détermination des structures secondaires ont été effectués grâce au logiciel CDtool et à l'algorithme ContinLL disponible sur le site en ligne DICHROWEB.
Ainsi, le repliement de l'oléosine S3 de la plante Arabidopsis thaliana a été déterminé dans son environnement natif, le corps lipidique. Les résultats indiquent la présence majoritaire de feuillets beta (cf fig. 2). Le même type de repliement est obtenu dans un détergent proche d'un phospholipide, la Foscholine 12, validant ainsi l'utilisation de ce détergent pour des analyses structurales à haute résolution (cristallographie).
Ces données ont permis de proposer un modèle de repliement de cette protéine - elles font l'objet d'une publication dans la revue BBA.
L'aventure continue, toujours à SOLEIL
Actuellement l'équipe DYSCOL poursuit ses travaux sur la ligne DISCO afin d'obtenir des données structurales sur d'autres oléosines mais aussi sur des protéines intégrales du corps lipidique de l'ensemble du règne vivant.
Par ailleurs, d'autres techniques d'analyses structurales sont utilisées : spectroscopie d’absorption infrarouge (sFTIR), diffusion des rayons X aux petits angles (SAXS), protéomique structurale, avec l’utilisation des lignes SMIS, SWING et METROLOGIE.
Référence :
"High water solubility and fold in amphipols of proteins with large hydrophobic regions: oleosins and caleosin from seed lipid bodies"
Gohon, Y., Vindigni, J. D., Pallier, A., Wien, F., Celia, H., Giuliani, A., Tribet, C., Chardot, T., Briozzo, P. (2011) BBA-Biomembranes, 1808(3): 706-716