Comment les microbes des grands fonds vivent-ils à partir d'éthane ? Des réponses obtenues dans un cristal jaune
Divers hydrocarbures sont naturellement libérés dans les grands fonds marins, mais quelque chose les consomme directement dans les sédiments. Les responsables sont des micro-organismes spécifiques, capables de transformer ces hydrocarbures en dioxyde de carbone en l'absence d'oxygène. L'une de ces communautés microbiennes a récemment été échantillonnée dans les sédiments des grands fonds et son étude a montré que l’éthane était l’unique alcane utilisé par ces micro-organismes pour récupérer l’énergie nécessaire à leur survie. L'enzyme responsable de la capture de l'éthane a été purifiée à partir de cette communauté microbienne et sa structure a été caractérisée par cristallographie aux rayons X. Cette structure, initialement déterminée à partir des données de diffraction collectées sur la ligne de lumière PROXIMA-1, est unique en son genre et révèle des caractéristiques structurales spécifiques qui la distinguent des enzymes capables de capturer le méthane.
L'activité géothermale dans les sédiments des grands fonds libère divers alcanes allant du méthane aux hydrocarbures à chaîne longue. La plupart de ces composés sont transformés biologiquement dans les couches supérieures des sédiments anoxiques, ce qui empêche leur émission dans la colonne d'eau puis notre atmosphère. En effet, il a été montré que des microorganismes, des archées, qui vivent en symbiose avec les bactéries sulfato-réductrices, convertissent entièrement les alcanes en CO2. À partir d'un échantillon de sédiments de grands fonds collecté à 2000 mètres de profondeur, Cedric Hahn et le Dr Gunter Wegener (Institut Max Planck pour la microbiologie marine, Brême, Allemagne) ont récemment réussi à cultiver à 50 °C une population microbienne transformant de l’éthane. Dans cette culture, la dégradation d'éthane est réalisée par une archée anaérobie, Candidatus Ethanoperedens thermophilum, qui semble incapable d'utiliser d'autres alcanes que l'éthane. Afin de fixer l’éthane, on soupçonnait cet organisme d’employer une protéine semblable à celle utilisée par les archées transformant du méthane. Cependant, la façon dont cette enzyme est spécialisée dans la fixation d’éthane était un mystère. La meilleure manière de résoudre cette énigme a été de déterminer sa structure tridimensionnelle.
Il existe différentes méthodes pour obtenir un « instantané » d'une structure de protéine, parmi lesquelles la cristallographie aux rayons X. Le type d'enzyme étudié ici est particulièrement adapté à cette technique, spécialité des Drs Olivier Lemaire et Tristan Wagner (Microbial Metabolism research group, Institut Max Planck, Brême, Allemagne). La cristallographie nécessite des cristaux de la protéine étudiée, protéine dont l'obtention peut être très fastidieuse. Sachant que, dans le cas présent, la protéine nécessite pour être active un cofacteur exotique (appelé F430) et différentes modifications post-traductionnelles (survenant après la synthèse de la protéine), il était impératif de la purifier directement à partir de l’enrichissement microbien, et non pas en essayant de la produire grâce à un autre système cellulaire. Or, c’était un véritable défi compte tenu de la faible quantité de cette précieuse culture, et du fait que Candidatus Ethanoperedens thermophilum n'était pas le seul organisme qu’elle contenait.
Heureusement, cette enzyme fixant l'éthane était très abondante dans la culture thermophile en raison de sa fonction essentielle. Elle a été isolée des autres protéines, puis des cristaux jaunes ont été obtenus à partir de cette préparation. Ces cristaux, congelés dans de l'azote liquide, ont d'abord été testés sur la ligne de lumière PROXIMA-1 à SOLEIL. Les rayons X produits par le synchrotron ont été diffractés par les cristaux de protéines puis les données de diffraction ont été collectées par le détecteur Eiger-16M de PROXIMA-1. La première structure d'une enzyme fixant l'éthane a été obtenue à partir de ces données de diffraction et présentait les caractéristiques spécifiques attendues.
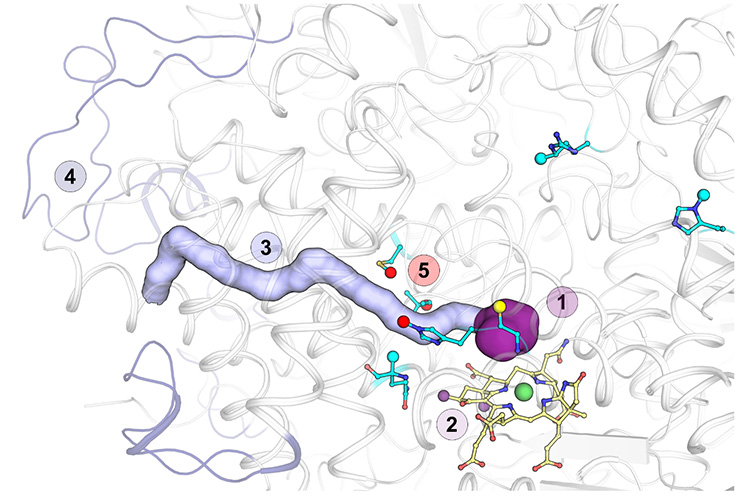
Par comparaison avec l'enzyme fixant le méthane, la protéine spécifique à l'éthane possède un site catalytique plus large, adapté à un alcane de plus grande taille. Le cofacteur F430, qui est le catalyseur de la réaction, contient deux méthylations supplémentaires confirmées par Jörg Kahnt, expert en spectroscopie de masse de l'Institut Max Planck pour la microbiologie terrestre (Marbourg, Allemagne). Ces méthylations semblent être cruciales pour placer correctement le cofacteur dans ce site catalytique plus large. En outre, l'atome de nickel catalytique du cofacteur F430 est coordonné par un atome de soufre d'un acide aminé (une méthionine), contrairement à la coordination par l'oxygène d'une glutamine parfaitement conservée dans toutes les autres enzymes de cette famille. Ceci devrait avoir des conséquences sur les propriétés du cofacteur.
Le volume plus important de la molécule d'éthane par rapport au méthane l'empêche de diffuser efficacement jusqu'au site catalytique enfoui. Pour surmonter ce problème, l'enzyme comporte un tunnel hydrophobe de 33 Å reliant la surface externe au site actif interne. Ce tunnel, absent dans toutes les autres enzymes connues de cette famille, a été confirmé par des expériences de pressurisation sous haute pression de Xénon réalisées par le Dr Sylvain Engilberge (Institut Paul Scherrer, Villigen, Suisse). Le tunnel est stabilisé par des acides aminés contenant des modifications post-traductionnelles et des extensions spécifiques de la protéine. De telles extensions sont conservées dans les autres archées fixant de l'éthane, ce qui permettra à l'avenir d'identifier plus simplement les enzymes spécifiques à l'éthane grâce à leur séquence d'acides aminés.
La caractérisation de cette enzyme a révélé plusieurs propriétés essentielles qui la rendent spécifique à l'éthane plutôt qu'aux autres hydrocarbures. Cette étude soulève aussi de nombreuses questions concernant les propriétés spécifiques d'autres enzymes capables de reconnaître des alcanes plus longs. La prochaine étape sera ainsi de caractériser ces enzymes provenant d'archées utilisant des hydrocarbures plus longs, notamment les enzymes oxydant le butane et le propane décrites récemment à l'Institut Max Planck de Brême.