Comment les êtres vivants fabriquent-ils des structures minérales ? Sur TEMPO, la photoémission X appliquée aux coquilles et aux coraux apporte une information à l'échelle moléculaire
Des mesures de spectroscopie de photoémission X réalisées sur la ligne de lumière TEMPO fournissent la première preuve directe et mesurable du lien existant entre les phases organiques et minérales dans les biominéraux calcaires. Ces résultats sont publiés dans la revue Analytical and Bioanalytical Chemistry.
Contexte de la recherche
De nombreux organismes vivants (principalement marins) sont capables de créer des structures minéralisées dédiées à des fonctions biologiques spécifiques, telles que les coquilles protectrices des mollusques (fig. 1a, b, c) ou encore les substrats calcaires construits par les coraux (fig.1d, e) dont l'accumulation produit des récifs d'une considérable importance géologique (fig.1f). Os et dents des Vertébrés illustrent également ces processus de formation d’organes minéralisés, dont le fonctionnement implique évidemment un contrôle précis de la mise en place des phases minérales.
Etablissement d’un processus commun sous-jacent à la diversité morphologique
La morphologie spécifique des coquilles calcaires est évidente, mais l’observation au microscope révèle que ces structures ne sont pas de simples agrégats de particules de carbonate de calcium. Elles apparaissent constituées de cristaux dont les tailles, les formes et les dispositions tri-dimensionnelles sont, elles aussi, propres à chaque espèce (ce qui est surprenant d’un point de vue cristallographique; figure 2). Malgré plus d’un siècle de recherches, le mécanisme de ce contrôle biologique de la cristallisation reste en grande partie une énigme.
En plus de leurs morphologies et dispositions spatiales spécifiques, les biocristaux calcaires révèlent une particularité plus importante encore : ils ne se développent pas le mode habituel de croissance cristalline tel qu’il se produit en solutions saturées. Ici, par exemple dans un squelette corallien de la (fig. 3a-b) la longueur des fibres cristallisées voisines (3c) est accrue simultanément par des couches de croissance communes à l’ensemble des composants de la structure calcaire (3d-e). On sait depuis longtemps que ces structures calcaires biogéniques contiennent toujours un composé organique (protéines et glucides associés en proportions variées selon les espèces, avec une présence récemment démontrée de lipides). La cartographie par absorption de rayons X montre que ces composés organiques (ici des polysaccharides sulfatés : 3f) sont distribués en exacte correspondance avec chaque couche de croissance minérale (3g). L'interaction organo-minérale, admise comme facteur du contrôle biologique de la cristallisation, s’effectue nécessairement à une échelle infra-micrométrique.
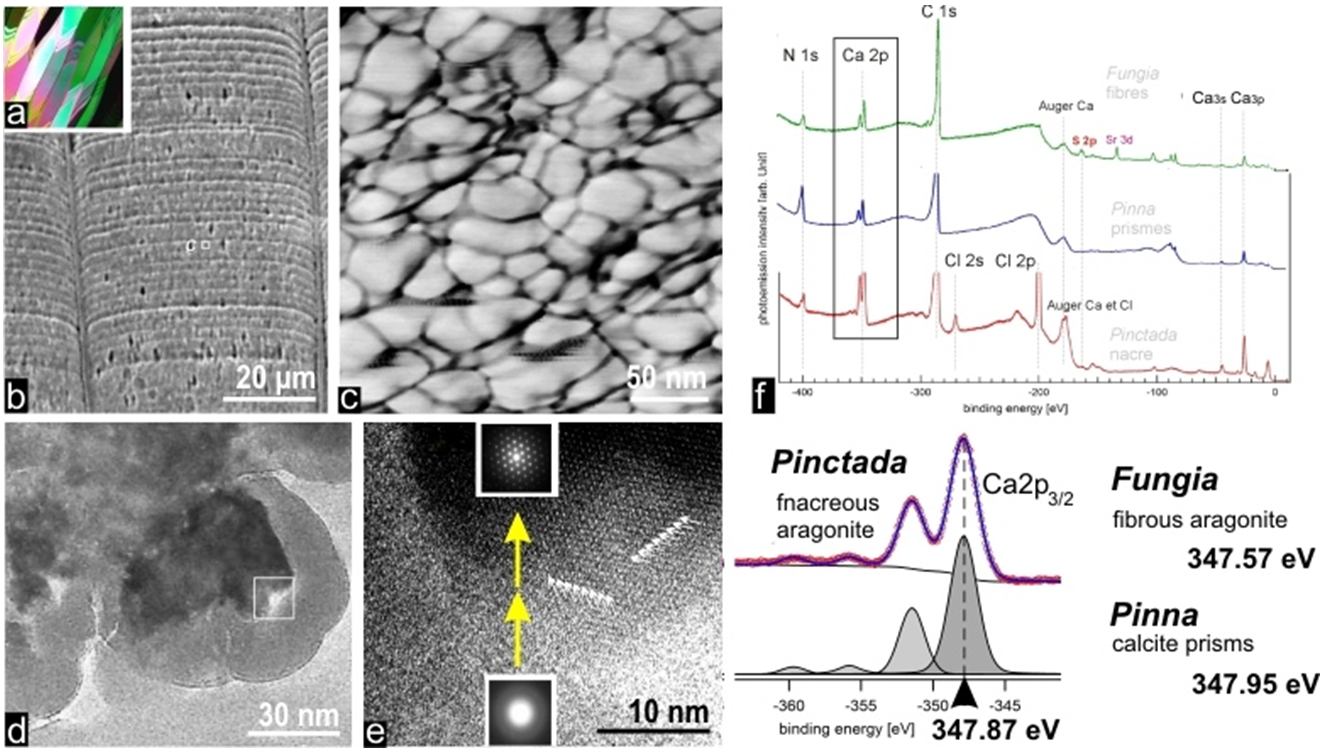
Il est possible d'accéder à la structure infra-micrométrique de ces matériaux en utilisant la microscopie à force atomique (AFM). Tous les carbonates biogéniques apparaissent alors constitués de grains étroitement jointifs, dépourvus de tout caractère indicatif d’une structure cristalline (tel que des facettes angulaires). Les prismes de la coquille des Pinna (mollusque Lamellibranche), dont le comportement global monocristallin a été un des premiers reconnu en microscopie optique (milieu du 19° siècle), présentent la stratification de croissance typique (figures 4a-b), chaque state étant formée de grains nodulaires irréguliers. L'imagerie AFM par contraste de phase montre à la périphérie des grains la présence d'un composé dont la forte interaction avec la pointe (variation des densités de gris, fig. 4c) suggère la nature organique.
En accord avec le modèle actuel d'une phase transitoire amorphe précédant l'état cristallin des biominéraux, l'imagerie par microscopie électronique à transmission appliquée au front de croissance des prismes de calcite présente une illustration réaliste de la cristallisation telle qu’elle peut se produire durant le passage d'un minéral amorphe à un minéral cristallisé (fig. 4d-e).
Entre la périphérie amorphe des grains et leur région interne cristallisée, les flèches jaunes (fig. 4e) attirent l'attention sur le processus clé qui se déroule : la transformation d’une phase minérale amorphe, stabilisée jusqu'à ce moment par une liaison avec la phase organique, passant progressivement à l’état cristallin sur l‘ensemble de la couche de croissance. Aucune information n'existe actuellement quant au mécanisme qui déclenche ce phénomène essentiel. Au sein de cette couche de croissance à son stade final de formation une forte ségrégation se produit: les composés organiques sont exclus du réseau cristallin en cours de formation. Ils se trouvent ainsi compactés à la périphérie des grains cristallisés, produisant l’enveloppe irrégulière riche en composés organiques détectée par le contraste de phase en AFM (fig. 4c).
Ainsi les matrices de minéralisation que les chercheurs ont collectées pendant des décennies en décalcifiant les coquilles ne sont rien d'autre que cette phase organique résiduelle qui, après avoir assuré une fonction essentielle dans la formation des couches de croissance, est restée incluse dans les unités minérales formant la coquille (mais pas au sein du réseau cristallin).
Apport de la photoémission
Les expériences de spectroscopie de photoémission X (XPS) effectuées sur la ligne TEMPO donnent ainsi un premier accès à cette phase clé du processus de biominéralisation. Par rapport aux énergies de liaison mesurées dans les niveaux équivalents du Ca en tant qu'élément libre ou inséré dans un réseau carbonate (calcite ou aragonite) les valeurs obtenues fournissent les premières informations sur les changements qui se produisent dans les orbitales 2p du calcium encore fixé à la matrice minéralisante.
Il est très remarquable que ces valeurs dépendent de l'origine biologique de la matrice organique porteuse du calcium (Fig. 4f), premier témoignage direct de la relation organo-minérale établie à l’échelle moléculaire (alors que les documents précédents (cartographie d’absorption X ou contraste de phase AFM) établissaient seulement une corrélation entre les distributions des composés organiques et minéraux).
Perspectives
Parmi les divers domaines dans lesquels les biominéraux calcaires sont impliqués, leur rôle d'enregistreur de certaines propriétés de l'eau de mer (notamment la température) présente une importance considérable dans le contexte actuel des changements environnementaux. Dans un article d’importance historique décrivant la première application environnementale de mesures physico-chimiques effectuées dans cet objectif (1951), Urey a formulé l’hypothèse qu’un « effet vital » pourrait exister pendant la formation des biominéraux, influençant le processus de cristallisation. Rapidement vérifiée (les fractionnements isotopiques et les teneurs en éléments mineurs incorporés aux biocristaux sont eux aussi propres à chaque espèce (caractère taxonomiquement dépendant des « proxies » chimiques et isotopiques). Ce fait, très largement dpocumenté maintenant, est très démonstratif des particularités du processus de biocristallisation. Il a une conséquence pratique lourdement négative : les géochimistes environnementaux ne peuvent opérer que sur des espèces préalablement « calibrées ».
Les données XPS récemment acquises sur la ligne TEMPO de SOLEIL constituent une illustration parfaite de cet effet vital au niveau moléculaire. La méthode XPS synchrotron offre une approche précise et fiable pour l’analyse des changements moléculaires se produisant lors de la formation des biominéraux calcaires. Elle peut ainsi apporter une contribution significative au développement un modèle réaliste de biocristallisation, progrès dont un des plus importants secteurs d’application serait de permettre une utilisation plus efficace des biominéraux en tant qu'archives naturelles des transformations environnementales en cours.
Recherche réalisée dans le cadre d'un contrat ANR (programme blanc n° 11BS1000502 - 3D- PtyCCoBio) sous la responsabilité de V. Chamard, Institut Fresnel, Marseille.