Un pont disulfure intramoléculaire régule l'affinité de la neuroglobine humaine pour l'oxygène
Une équipe française a déterminé la structure de la neuroglobine humaine, mettant en évidence un nouveau mécanisme de régulation de l’affinité pour l’oxygène de la neuroglobine.
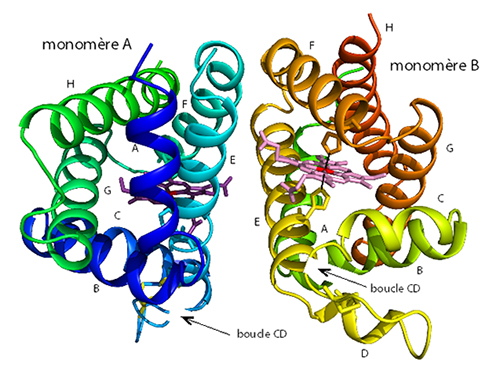
La neuroglobine est une petite protéine de la famille des globines découverte en 2000, qui est présente dans le cerveau des vertébrés. Bien que ses fonctions au sein de l’organisme soient encore mal connues, elle est surexprimée en conditions d'hypoxie (oxygénation insuffisante), assurant ainsi la protection des cellules. Contrairement aux autres globines où le sixième site de coordination du fer de l'hème est accessible et permet de lier l'oxygène, l'histidine dite "distale" en position 64 est ligand du fer de la neuroglobine aussi bien dans l'état oxydé que dans l'état réduit. Il a été proposé que cette hexacoordination constitue un nouveau mécanisme de régulation car, dans ce cas, l'étape limitante pour la liaison d'un ligand exogène est la rupture de la liaison entre le fer hémique et l'histidine distale.
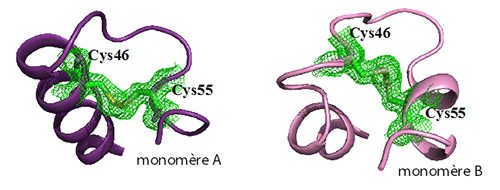
L'hypothèse avait été émise que dans la neuroglobine humaine, la formation d'un pont disulfure entre les cystéines 46 et 55 (présentes dans la boucle CD liant les hélices C et D) diminuerait l'affinité de l'histidine distale pour le fer hémique, augmentant ainsi l'affinité pour l'oxygène. Cependant, jusqu'à présent, il n'y avait aucune donnée structurale permettant de visualiser ce pont disulfure et d'expliquer sa fonction de régulation.
Les équipes de Michael Marden (INSERM) et Béatrice Golinelli-Pimpaneau (Collège de France, CNRS, Paris) ont déterminé, grâce à des expériences de diffraction aux rayons X sur la ligne PROXIMA1 du synchrotron SOLEIL, la structure de la neuroglobine humaine. Le cristal contient deux structures de la protéine dans lesquelles le pont disulfure est formé mais adopte des conformations différentes, révélant ainsi sa grande flexibilité. L'analyse de la structure identifie la formation d'une nouvelle cavité interne dans la région de la boucle CD lors de la formation du pont disulfure. Cette cavité pourrait permettre la mobilité conformationnelle de l'histidine distale de la neuroglobine humaine, et réguler ainsi la dynamique de l'équilibre entre les formes hexa et pentacoordinées, ou encore déplacer le chemin de migration du ligand. Ce nouveau mécanisme de régulation de l'affinité pour l'oxygène de la neuroglobine, impliquant la formation d'un pont disulfure intramoléculaire, serait spécifique des mammifères en dehors des rongeurs.