Pour la première fois, une collaboration scientifique entre l’université de Lund (Suède) et la ligne de lumière SMIS du Synchrotron SOLEIL a élucidé la conformation d’agrégats amyloïdes nanométriques directement dans des neurones de souris Alzheimer à l’aide de la spectroscopie photothermique infrarouge optique, une nouvelle technique de super-résolution combinant une source de lumière infrarouge pulsée et un laser dans le domaine visible.
En raison d’une espérance de vie prolongée et du vieillissement de la population, la maladie d’Alzheimer – la principale maladie neuro-dégénérative représentant 70% des cas de démences séniles – affecte cinquante millions de personnes dans le monde et sa prévalence augmente rapidement. La maladie d’Alzheimer ne peut pas être soignée avec les traitements disponibles à l’heure actuelle et la recherche de nouveaux moyens de traitement et de diagnostic est nécessaire. Les données génétiques, physiologiques et biologiques pointent le rôle central de l’agrégation amyloïde du peptide Aβ dans le développement de la maladie. Le peptide Aβ est généré par le clivage intracellulaire de la protéine APP. Selon la théorie de la ‘cascade amyloïde’, l’accumulation graduelle de peptides Aβ monomériques dans les neurones et dans l’espace extracellulaire conduirait à l’oligomérisation des monomères, puis à leur polymérisation en fibrilles et finalement à l’agrégation de plaques amyloïdes conduisant à la mort neuronale. Bien que les monomères Aβ soient considérés comme potentiellement inoffensifs, leur agrégation sous forme de fibrilles leur conférerait une structure anormale, neurotoxique dite conformation β-amyloïde. L’étude du mécanisme d’agrégation des peptides Aβ est donc considérée cruciale pour comprendre les mécanismes de la toxicité des structures amyloïdes et pour développer des traitements capables de les contrer.
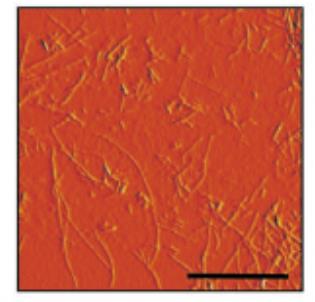
Image par microscopie à force atomique (AFM) de fibrilles β-amyloïdes. La barre d’échelle correspond à 200 nm.
Le mécanisme d’agrégation du peptide Aβ en fibrilles β-amyloïde peut être étudié in vitro mais les conditions régnant à l’intérieur des neurones ne peuvent pas être reproduites de façon suffisamment précise. Différentes méthodes existent pour visualiser les plaques amyloïdes in vivo (microscopies électronique, confocale avec immuno-marquage, colorations histologiques) mais elles ne donnent pas ou peu d’information sur la conformation des peptides, manquent de spécificité ou nécessitent des traitements chimiques pouvant altérer la conformation des peptides Aβ. En outre, ces méthodes ne pourraient pas discerner un éventuel polymorphisme des agrégats Aβ.
Les méthodes de microspectroscopie vibrationnelle telles que l’infrarouge à transformée de Fourier (µIRTF) permettent d’élucider, de façon non-perturbatrice, la conformation des peptides, des protéines et des structures d’ordre supérieur telles que les fibrilles et les plaques protéiques1,2. La conformation β-amyloïde possède une signature spécifique en microspectroscopie infrarouge3. La microspectroscopie µIRTF synchrotron telle que pratiquée sur la ligne SMIS du synchrotron SOLEIL a permis de mesurer la signature amyloïde de petites inclusions de protéines de quelques microns4,5 directement dans les neurones de coupes histologiques de cerveaux de patients atteints de la maladie de Huntington ou de souris modèles et ce de façon non-destructive. Cependant, même en utilisant la source synchrotron, la résolution spatiale de la méthode reste limitée par la diffraction de la lumière infrarouge à des dimensions de quelques microns (3-10 µm) dépendant de la longueur d’onde. De plus, en raison de la forme des neurones isolés, le phénomène de diffusion de Mie (diffusion de la lumière particulière sur des objets circulaires de taille similaire à la longueur d’onde) peut rendre l’interprétation des spectres très difficile. Cela est dû à la relation fondamentale entre les phénomènes physiques d’absorption et de réfraction (capturée par la loi de Kramers-Kronig). Il est donc très difficile d’étudier l’agrégation β-amyloïde à l’échelle subcellulaire dans des modèles de neurones isolés en culture directement par µIRTF.
Ces limitations peuvent être surpassées par l’utilisation d’une nouvelle technique de super-résolution, la spectroscopie photothermique infrarouge optique (PTIRO) disponible depuis 2019 sur la ligne SMIS. Cette technique est basée sur l’excitation infrarouge d’un échantillon par une source infrarouge brillante pulsée et la lecture de la réponse de l’échantillon (changement d’indice de réfraction et de réflectivité) par un laser dans le domaine visible (532 nm ici) permettant de combiner les informations chimiques et de conformation de la microspectroscopie infrarouge et la résolution spatiale de la microscopie visible. La méthode permet d’atteindre des résolutions de quelques centaines de nanomètres (400 nm dans cette étude) sans marquage et sans modification chimique de l’échantillon.
Dans cette étude6, l’équipe d’Oxana Klementieva de l’université de Lund (Suède) en collaboration avec l’équipe de la ligne SMIS (Synchrotron SOLEIL) a étudié la conformation d’agrégats β-amyloïdes de peptides Aβ humains directement dans des neurones de souris génétiquement altérés pour produire le fragment β1-42 de la protéine APP humaine capable de générer des fibrilles amyloïdes. La technique µIRTF synchrotron été utilisée pour mesurer la conformation des agrégats à l’échelle d’amas de neurones et la technique PTIRO pour mesurer des agrégats à l’échelle subcellulaire dans les neurites (axone ou dendrites) et les épines dendritiques des neurones.
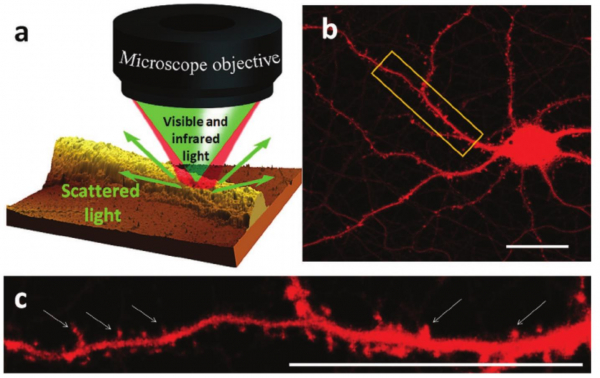
a) Principe de la microspectroscopie PTIRO. Un objectif focalise un laser vert et un laser infrarouge pulsé sur la même région de l’échantillon. La source IR excite l’échantillon dont les changements de propriétés optiques locales sont lus par le laser vert donnant une résolution spatiale latérale élevée de l’ordre de 400 nm dans la configuration utilisée dans cette expérience
b) image confocale laser d’un neurone de souris en culture, échelle 20 µm
c) zoom sur la région marquée dans un cadre jaune en b. Les flèches blanches marquent les épines dendritiques le long d’une neurite du neurone.
Les résultats montrent que la signature spectrale des agrégats β-amyloïdes mesurée in vivo dans les neurones par µIRTF synchrotron est différente de celle de fibrilles Aβ1-42 polymérisées in vitro. Les différences spectrales sont observées dans les pics d’absorption infrarouge caractéristiques des structures désordonnées suggérant que les mécanismes d’agrégation diffèrent in vivo et in vitro. Grâce à la technique PTIRO, il a été possible de détecter des agrégats de structure β-amyloïde de quelques centaines de nanomètres même dans les épines dendritiques des neurones, ce qui n’avait jamais été observé auparavant. En outre, ces nano-agrégats avaient une signature spectrale différente de celle observée à l’échelle des cellules entières révélant un polymorphisme des agrégats in vivo avec une structure moins ordonnée et probablement non-fibrillaire. Ces agrégats β-amyloïdes moins ordonnés détectés dans les épines dendritiques semblaient structurellement distincts de ceux détectés dans les neurites. Ces différences pourraient correspondre à l’existence d’agrégats amyloïdes dits ‘amorphes’ qui sont supposés être les plus toxiques pour les cellules.
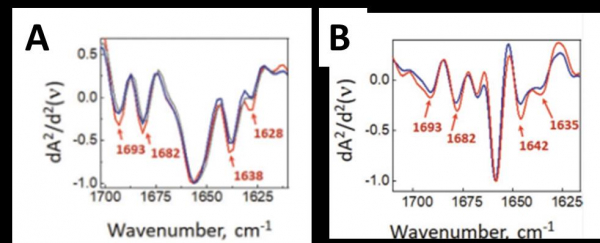
A) Spectres µIRTF synchrotron des agrégats amyloïdes (rouge) et d’un amas de neurones contrôle (bleu).
B) Spectres PTIRO de nano-agrégats Aβ (rouge) et d’une épine dendritique (bleu) montrant des différences à 1638-1642 cm-1 (structures désordonnées) et 1628-1635 cm-1 (feuillets β-amyloïdes).
--------------------------
(1) Zandomeneghi, G. et al. Protein Sci. 2004 Dec; 13(12): 3314–3321
(2) Hiramatsu, H.; Kitagawa, T. Biochim. Biophys. Acta 2005, 1753 (1), 100–107
(3) Hiramatsu, H. et al. J. Am. Chem. Soc. 2004, 126, 10, 3008–3009
(4) Hoffner, G. et al. Rev. Anal. Chem. 2014, 33 (4), 231–243
(5) André, W. et al. Anal. Chem. 2017, 89, 10, 5201–5209
(6) Voir ci-contre, rubrique "publication associée"
